Con l’entrata in vigore della nuova normativa europea UE Medical Device Regulation EU MDR sulla tracciabilità dei dispositivi medici, produttori e distributori dovranno fronteggiare il cambiamento normativo implementando un sistema unico di identificazione UDI (Unique Device Identification), in base ad una timeline basata sulle classi, su tutti gli imballaggi di dispositivi medici.
Il termine “dispositivo medico” è ampio e copre una vasta gamma di oggetti. Si riferisce più comunemente a un apparecchio o un pezzo di equipaggiamento che entra in contatto diretto con il paziente per trattare o diagnosticare una condizione clinica.
La frequenza con cui incontriamo dispositivi medici nella nostra vita quotidiana è sorprendentemente alta e il ruolo chiave che svolgono nel nostro benessere rimane innegabile. È a causa di questo ruolo che le normative relative ai dispositivi medici tendono a essere sottoposte a un controllo più rigoroso.
Monitorare la tracciabilità dei dispositivi medici – UDI
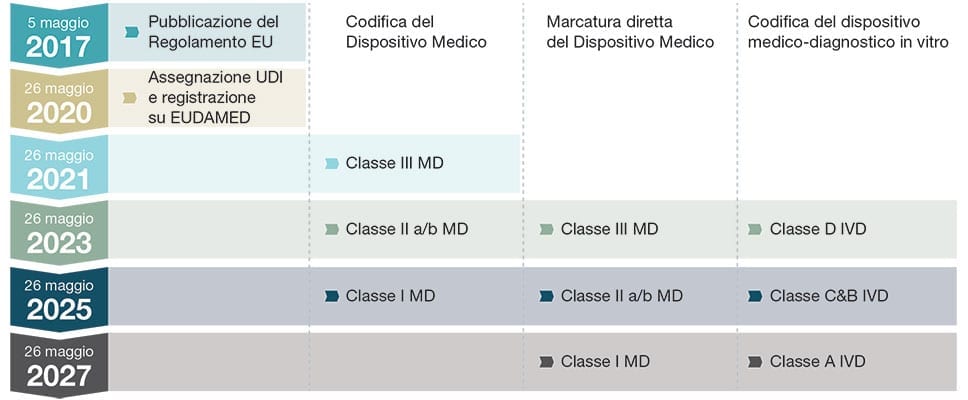
Secondo le regole dettate dal FDA (Food & Drug Administration) negli Stati Uniti, i produttori sono tenuti a implementare un sistema unico di identificazione UDI (Unique Device Identification) su tutti gli imballaggi di prodotti medicali dal settembre 2014. A seguito di questo e alla luce del regolamento sui dispositivi medici recentemente adottato dell’UE, i produttori di dispositivi medici si sono trovati ad affrontare normative ancora più severe per garantire che i loro prodotti siano sicuri in base alle nuove leggi dell’UE entrate in vigore dal 26 maggio 2020 in poi.
 Clicca qui per scaricare il white paper nimax sulla Normativa per la tracciabilità dei dispositivi medici
Clicca qui per scaricare il white paper nimax sulla Normativa per la tracciabilità dei dispositivi medici
La normativa europea MDR vedrà anche l’introduzione di un nuovo sistema unico di identificazione (UDI) per la tracciabilità dei dispositivi medici.
Cosa è l’UDI?
L’UDI (Unique Device Identification) è un codice numerico o alfanumerico univoco composto da due parti:
1. Identificativo del Dispositivo (UDI-DI).
Identifica la versione o il modello specifico di un prodotto (Obbligatorio e Fisso).
2. Identificativo della Produzione (UDI-PI). È variabile e può contenere uno o più delle seguenti informazioni:
- Numero di lotto o batch ove il dispositivo è stato prodotto
- La data di scadenza di uno specifico dispositivo
- Il serial number se richiesto per specifici dispositivi
Ripartizione delle classi dei dispositivi medici
Le tempistiche per il rispetto della normativa MDR sulla codifica UDI dei dispositivi medici dipendono dalla classe associata al tipo di dispositivo medico. La classificazione del dispositivo medico è basata sul livello di rischio associato al dispositivo in esame. In particolar modo ai dispositivi medici di Classe III è associato un alto livello di rischio per il paziente.
- Classe III: pacemaker impiantabili, generatori di impulsi, test diagnostici dell’HIV, defibrillatori automatici esterni, impianti endossei e lenti a contatto a utilizzo prolungato.
- Classe II a / b: aghi per agopuntura, lenti a contatto giornaliere, sedie a rotelle motorizzate, pompe per infusione, teli chirurgici e sistemi transponder a radiofrequenza impiantabili per l’identificazione del paziente e delle informazioni sanitarie.
- Classe I: bende elastiche, guanti in lattice e strumenti chirurgici portatili.
Per la classificazione di tutti i dispositivi medici fare riferimento all’allegato VIII e all’allegato XVI incluso nell’MDR dell’UE.
In che modo la normativa europea MDR influisce sulla codifica e sulla marcatura per la tracciabilità dei dispositivi medici?
I produttori di dispositivi medici, inoltre, hanno l’obbligo legale di garantire entro il 26 maggio 2022 che sia assegnato e registrato un codice UDI in EUDAMED (il database europeo per la registrazione e la codifica dei dispositivi medici) per ogni singolo articolo prodotto, assieme a tutte le altre informazioni obbligatorie contenute nell’Annex VI Part B del regolamento.
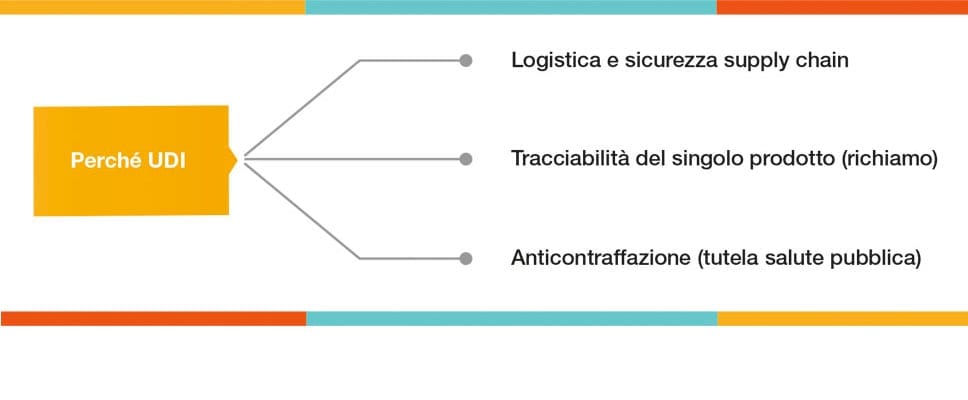
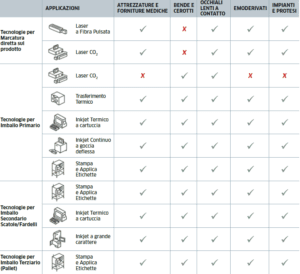
Il mancato rispetto della legislazione avrà ripercussioni sui produttori che non saranno più in grado di fornire i loro prodotti a tutti gli stati membri dell’UE. La tecnologia per assegnare, applicare e verificare i codici di identificazione a una vasta gamma di prodotti è una risorsa fondamentale. I vantaggi sono molteplici e si applicano a numerose industrie del settore medicale, in cui l’UDI è il metodo accettato per identificare e rintracciare i dispositivi medici durante il loro ciclo di vita, dalla produzione alla distribuzione e infine all’uso da parte dei consumatori.